Rückstände von Tierarzneimitteln im Essen – Defizite bei der Regulierung
Den zweiten Teil der Blogreihe zu den Defiziten bei der Regulierung von Schadstoffen widme ich den Tierarzneimitteln. Der Artikel ist viel länger geworden als ich geplant hatte und unterteilt sich in mehrere Kapitel. Am Anfang beschreibe ich kurz die Datenlage zum Einsatz von Tierarzneimitteln, dann die Rückstandssituation und die Giftigkeit der Wirkstoffe. Im weiteren gehe ich auf die Festlegung der Höchstgehalte für Rückstände ein und stelle die Schwächen der Regulierung dar. Zum Schluß gibt es ein Fazit.
Einsatz von Tierarzneimitteln
Tierarzneimittel (TAM) werden in der intensiven Tierhaltung in relativ großen Mengen eingesetzt (nur Antibiotka: 805 Tonnen im Jahr 2015 in DE). Die Datenlage über den Einsatz ist aber nach wie vor ungenügend. Die Arzneimittelverordnung schreibt zwar Berichtspflichten vor, diese beschränken sich jedoch nur auf einen Teil der eingesetzten Antibiotika und einen Teil der Tierarten. Antibiotika und andere Tierarzneimittel in Futtermittelzusatzstoffen (z.B. Lasalocid A, Monensin sodium, Narasin, Maduramicin ammonium, Diclazuril – hier geht es zum EU Register) werden nicht erfasst.
Kennzahlen zur Therapiehäufigkeit mit Antibiotika erfassen nur Masttiere und keine Milch oder Eier produzierenden Tiere. Nach einer Recherche von NDR; WDR und der Süddeutschen Zeitung stellen die gemeldeten Antibiotika-Daten eine grobe Unterschätzung dar. Hochgiftige Mittel, die extern gegen Parasiten eingesetzt werden (Insektizide) fallen auch nicht unter die Berichtspflicht nach der DIMDI-Arzneimittelverordnung.
Tierarzneimittel in Lebensmitteln
Über das Vorkommen von Tierarzneimitteln in Lebensmitteln war bisher wenig bekannt. Das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) veröffentlicht Zahlen zu Rückständen nur, wenn gesetzliche Höchstgehalte überschritten werden (siehe dazu “Amt schützt Verbraucher vor Informationen“). Die Auswertung der Lebensmittelüberwachungsdaten für die Smartphone APP „Essen ohne Chemie“ zeigte jedoch, dass die Belastung von Lebensmitteln mit Tierarzneimitteln verhältnismäßig gering zu sein scheint. Mit Antibiotika belastet sind vor allem Innereien. Andere Stoffe befinden sich auch gelegentlich im Fleisch, hier handelt es sich jedoch um vergleichsweise geringe Mengen. Die Lebensmittelüberwachung untersucht allerdings keine antibiotischen Tierarzneimittelrückstände in pflanzlichen Lebensmitteln [1] (außer sie werden direkt im Pflanzenschutz eingesetzt). Antibiotika u.a. Tierarzneimittel können ggf. über Düngung (Gülle/Mist->Boden) von Pflanzen aufgenommen werden (siehe weiter unten).
Giftigkeit von Tierarzneimitteln
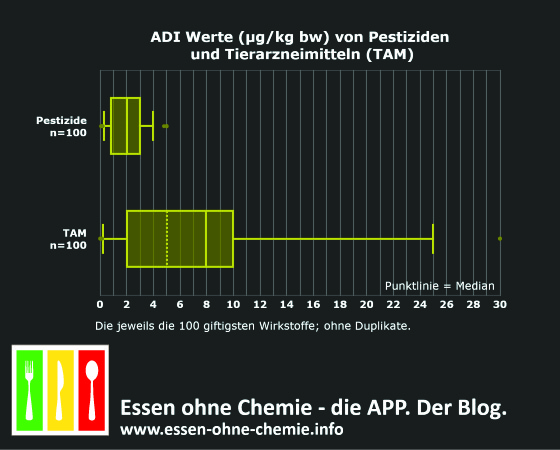
Obwohl viele Tierarzneimittel zur Behandlung von Krankheiten eingesetzt werden, sind sie nicht automatisch ungiftig. Einige Tierarzneimittel können chronisch hochgiftig sein. Die chronische Giftigkeit lässt sich gut am ADI-Wert ablesen (siehe Glossar) – je kleiner dieser Wert ist, desto giftiger ist ein Stoff. Flunixin hat beispielsweise einen ADI Wert von 0,006 mg/kg Körpergewicht. Sisapronil, der „kleine Bruder“ des extrem problematischen Fipronil [2] hat sogar einen ADI-Wert von 0,001 mg/kg Körpergewicht. Verglichen mit Pestiziden würden diese Stoffe im oberen Drittel der Giftigkeit liegen.
Um die potenzielle chronische Giftigkeit von Tierarzneimitteln besser dazustellen, habe ich die ADI Werte aller Tierarzneimittel für die es RHG gibt mit den ADI Werten von hochgiftigen Pestiziden verglichen. Die nachstehende Abbildung zeigt die Resultate für die jeweils 100 giftigsten Wirkstoffe. Stoffe, die in beiden Kategorien vorkommen (einige Pyrethroide, Organophosphate, Mectine) habe ich weggelassen.
Die Hälfte der chronisch giftigen Tierarzneimittel hat einen ADI-Wert kleiner als 5 µg/kg Körpergewicht (0,005 mg/kg KG) und sind damit – toxikologisch betrachtet – durchaus mit (chronisch) hochgiftigen Pestiziden vergleichbar.
Neben der direkten Giftigkeit könnten resistente Keime für Menschen tödlich sein. Diese resistenten Keime können zur Gefahr werden, wenn biologisch wirksame Stoffe häufig (bzw. auch unsachgemäß) eingesetzt werden. Viele Tierarzneimittel (Wirkstoffe) werden ebenfalls in der Humanmedizin eingesetzt und einige zudem noch im Pflanzenschutz (z.B. Azolfungizide), so dass es zu einer vielfältigen Anwendung kommt. Mit der Häufigkeit des Einsatzes dieser Mittel steigt die Gefahr von Resistenzen[3]. Das Thema resistente Keime wird an dieser Stelle aber nicht weiter ausgeführt.
Zulassung von Tierarzneimitteln und Festlegung von Höchstgehalten
Tierarzneimittel unterliegen einem Zulassungsverfahren. Manche Tierarzneimittel werden jedoch als Futtermittelzusatzstoffe deklariert (siehe oben) und durchlaufen daher ein anderes Zulassungsverfahren.
Das Zulassungsverfahren von Tierarzneimitteln nach Verordnung 470/2009/EC ist in der EU harmonisiert und wird von der EMA (European Medicines Agency) gesteuert. Auch die Rückstandshöchstgehalte (RHG) in Lebensmitteln werden von der EMA vorgeschlagen. Die Europäische Behörde für Lebensmittelsicherheit (EFSA) ist nicht beteiligt, obwohl sie sehr viel Erfahrung mit der Einschätzung der Aufnahme von Schadstoffen hat.
Die Rückstandshöchstgehalte leiten sich in der Regel aus den gemessenen bzw. zu erwartenden Rückständen im Tier bzw. im Produkt (Fleisch, Ei, Milch) nach einer Therapie/Behandlung ab. Dabei wird auch der Abbau im Körper und ggf. Wartezeiten berücksichtigt.
In der Verordnung (EU) 37/2010 werden alle erlaubten Tierarzneimittel und wenn notwendig, die RHG aufgelistet (gegenwärtig ca. 760). Diese Verordnung führt auch verbotene Tierarzneimittel (z.B. Chloramphenicol und Nitrofurane) auf, für die immer eine Nulltoleranz gilt.
Insgesamt sind ca. 650 Substanzen als/in Tierarzneimittel/n zugelassen [4] (Stand Februar 2017). Für die überwiegende Anzahl der Stoffe (n=513) wurden keine RHG bestimmt. Bei diesen Stoffen geht die EMA entweder davon aus, dass es keine Rückstände gibt oder diese Stoffe ungiftig sind.
RHG werden in der Regel für bestimmte Körperteile (Muskelfleisch, Leber, Nieren, Fett, Haut) und/oder Produkte (Eier, Milch) der behandelten Tiere festgelegt. Für Rückstände ohne Zulassung gilt eine Nulltoleranz d.h. jeder Rückstand von Stoffen für die es keine „RHG Befreiung“ oder einen RHG gibt, wird als Verstoß angesehen.
Schwächen der Regulierung und der Risikobewertung
Für die Zulassung der Tierarzneimittel und Bestimmung der RHG wird die Giftigkeit der Stoffe mittels verschiedener Langzeit- und Kurzzeitstudien eingeschätzt und wenn nötig ADI Werte ermittelt. Die Ermittlung von ADI Werten ist ein standardisierter Vorgang und hat viele Schwächen (siehe u.a mein Artikel von Menschen und Mäusen).
Für die Einschätzung des möglichen chronischen Risikos für den/die VerbraucherIn berechnet die EMA die Ausschöpfung der akzeptablen täglichen Aufnahme (% ADI). Die RHG sollten immer so liegen, dass niemals 100% der akzeptablen täglichen Aufnahme erreicht werden.
Die Verordnung 470/2009/EC verlangt keinen Schutz besonders empfindlicher Gruppen.
Daher führt die EMA keine Expositionseinschätzung und keine Risikobewertung für Kinder durch. Messlatte für die EMA ist immer ein Mensch mit einem Körpergewicht von 60kg. Das führt zu einer starken Unterschätzung des Risikos für Kinder. Kinder essen, bezogen auf ihr Körpergewicht wesentlich mehr als Erwachene (siehe Abbildung im Einführungsartikel) und nehmen dadurch generell mehr Schadstoffe auf.
Die folgende Tabelle zeigt beispielhaft die Berechnung der chronischen Giftigkeit von möglichen Rückständen von Eprinomectin (PDF). Die EMA berechnet für einen 60kg schweren Menschen eine ADI Ausschöpfung von 92,2% und leitete daraus ab, dass kein Risiko für den/die VerbraucherIn existiert.
Berechnet man das Risiko aber für Menschen mit geringerem Körpergewicht, wird die akzeptable tägliche Aufnahme (% Total ADI > 100%) überschritten.
Tabelle 1: Berechnung der chronischen Giftigkeit von möglichen Rückständen von Eprinomectin für unterschiedliche Körpergewichte
| Essbares Gewebe | Täglicher Verzehr (kg) | EMA RHG Vorschlag (μg/kg) | Wirkstoffmenge im essbaren Gewebe (µg) | % ADI bei 60 kg | % ADI bei 40 kg | % ADI bei 20 kg |
|---|---|---|---|---|---|---|
| Muskel | 0,3 | 50 | 20 | 6,7 | 10,0 | 20 |
| Fett | 0,05 | 250 | 12,5 | 4,2 | 6,3 | 12,5 |
| Leber | 0,1 | 1500 | 187,5 | 62,5 | 93,8 | 187,5 |
| Niere | 0,05 | 300 | 19 | 6,3 | 9,5 | 19 |
| Milch | 1,5 | 20 | 37,5 | 12,5 | 18,8 | 37,5 |
| Total % ADI | 92,2 | 138,3 | 276,5 |
Die ADI Ausschöpfung >90% für Erwachsene durch Eprinomectin ist kein Einzelfall. Bei mindestens sechs weiteren Tierarzneimitteln (Apramycin, Doramectin, Cefacetril, Ivermectin, Neomycin, Sisapronil) werden bereits für Erwachsene > 90% der akzeptablen täglichen Aufnahme erreicht, wenn die Rückstände den RHG erreichen würden. Für Kinder könnten Rückstände in Höhe der RHG ein gesundheitliches Risiko darstellen.
Keine Betrachtung der Belastung mit gleich wirkenden Stoffen
Eprinomectin ist ein neurotoxisches Insektizid und sehr ähnliche Stoffe werden sowohl im chemischen Pflanzenschutz (Abamectin, Emamectin benzoate, Milbemectin) als auch bei anderen Nutztieren und Haustieren (Ivermectin, Doramectin) eingesetzt.
Man sollte davon ausgehen, dass alle diese Stoffe zusammen mit anderen neurotoxischen Stoffen in eine gemeinsame toxikologische Bewertungsgruppe (cumulative assessment group) gehören.
Die EMA berücksichtigt zwar die mögliche zusätzlich Stoffaufnahme, wenn ein Stoff auch im chemischen Pflanzenschutz eingesetzt wird – aber dabei handelt es sich dann um den gleichen Stoff. Die EMA berücksichtigt nicht, das VerbraucherInnen täglich mehreren gleich wirkenden Stoffen (z.B. neurotoxischen Stoffen; hormonell wirksamen Stoffen) ausgesetzt sind.
Die Verordnung (EU) 470/2009 sieht keine Risikobewertung für gleich wirkende Stoffe vor.
Fehlende Expositionspfade
Viele Tierarzneimittel sind stark wasserlöslich und können über Stallmist und Gülle wieder auf die landwirtschaftlichen Flächen gelangen (UBA 2014). Der Artikel 6 der VO 470/2009/EC („Wissenschaftliche Risikobewertung“) verlangt auch dass bei der Expositionsabschätzung „Rückstände, die in Lebensmitteln pflanzlichen Ursprungs auftreten oder die aus der Umwelt stammen“ berücksichtigt werden.
In keinem der EMA Berichte, die ich mir angesehen habe (n > 100), gibt es einen Hinweis darauf, dass die mögliche Exposition über den Pfad: Gülle-Boden-Pflanze-Verbraucher oder über Gülle-Trinkwasser-Verbraucher einbezogen wurde. Letzteres ist bisher kaum relevant (siehe UBA 2014).
Wie relevant die Aufnahme (Gülle-Boden-Pflanze-Verbraucher) ist, ist bisher unbekannt. Untersuchungen (Grote et al. 2007) zeigten, dass intakte Pflanzen beträchtliche Mengen an bestimmten Antibiotika über die Wurzel aufnehmen können. Die Autoren können nicht ausschließen, dass Rückstände in Pflanzen zur Entwicklung von menschlichen Antibiotikaresistenzen beitragen (ebenda). Ansonsten gibt es kaum wissenschaftliche Literatur oder Daten zum Thema.
Eine Art meta-Analyse des BfR (2011) wertete etwa zehn Studien aus und schlussfolgerte das: „der Transfer pharmakologisch wirksamer Stoffe in pflanzliche Lebensmittel generell möglich ist. Für 22 pharmakologische Wirkstoffe ergaben sich Befunde oberhalb der jeweiligen analytischen Bestimmungsgrenzen.“
Einige Wirkstoffe, die in der Tierproduktion eingesetzt werden, finden auch Anwendung im Haushalt. Viele Mückensprays enthalten z.B. Pyrethroide. Eine Pilotstudie in Frankreich fand u.a. heraus, dass die häusliche Exposition zu Pestiziden u.U. höher sein kann, als die professioneller PestizidanwenderInnen (Bouvier et al. 2006). Viele Haustierbesitzer behandeln ihre Tiere ebenfalls mit Insektiziden gegen Flöhe und Zecken. Flohhalsbänder sind z.B. eine weitere signifikante Quelle für die Aufnahme von Insektiziden (siehe u.a. Davis et al. 2008), da viele TierbesitzerInnen sehr engen Kontakt zu ihren Tieren haben.
Auch wenn man die Gesamtexposition zu bestimmten Stoffen/Stoffgruppen vielleicht niemals komplett erfassen kann, sollte jede Risikobewertung einen “Puffer” für unbekannte Expositionen einräumen. Die EMA setzt die Vorgaben zur Expositionsabschätzung unzureichend um und setzt die dementsprechend RHG zu hoch an. Zu erwartende Rückstände eines einzelnen Stoffes dürfen nicht schon 90% der akzeptablen Aufnahme erreichen, wenn man annehmen muss, dass weitere Expositionen zu gleichen/ähnlichen Stoffen existieren.
Fazit
Tierarzneimittel werden regelmäßig in der Tierhaltung eingesetzt. Bei den Daten zum Einsatz gibt es große Lücken, so dass man über den wahren Umfang nichts weiß. Viele der durch RHG regulierten Tierarzneimittel weisen eine hohe chronische Giftigkeit auf. Die Aufnahme von Tierarzneimitteln durch den Verzehr von Lebensmitteln tierischer Herkunft kann als sehr gering eingestuft werden. Die gegenwärtig eingesetzten Tierarzneimittel werden in nur geringem Umfang in Lebensmitteln nachgewiesen.
Die Verordnung (EU) 470/2009 weist erhebliche Mängel beim Verbraucherschutz auf:
- Verzehrgewohnheiten und die besondere Empfindlichkeit bestimmter Verbrauchergruppen werden nicht berücksichtigt,
- die Vorgabe andere Expositionsquellen zu berücksichtigen, wird nicht ausreichend umgesetzt,
- es gibt keine kumulative Risikobewertung, die gleich wirkende Stoffe zusammen betrachtet.
Man könnte argumentieren, dass angesichts der geringen Verbraucherexposition kein Handlungsbedarf besteht und die Verordnung (EU) 470/2009 Verbraucher ausreichend schützt. Aber das tut sie eben nicht. VerbraucherInnen mit einem Körpergewicht unter 60 kg werden nicht geschützt. Jede Verordnung, die (auch) dem Verbraucherschutz dient, muss sich an den empfindlichsten Verbrauchergruppen orientieren. Ganz unabhängig von der Exposition. Das Tierarzneimittel bisher wenig in Lebensmitteln vorkommen, ist kein Verdienst der Verordnung (EU) 470/2009. Das hat eher mit dem Verhalten der Stoffe im Tierkörper zu tun. Neue Stoffe könnten sich ggf. anders verhalten und eine Verordnung muss vorsorgend schützen.
Alle Expositionspfade, auch zu gleich wirkenden Stoffen müssen in ihrer Gesamtheit betrachtet werden, alles andere ist unwissenschaftlich. Jede moderne Verordnung zum Verbraucherschutz sollte die Gesamtheit der Exposition (aller Stoffe) berücksichtigen. Wie das aussehen könnte, werde ich zum Abschluß der Artikelreihe darstellen.
Fußnoten und Literatur
[1] Auswertung der Rückstandsdatenbank des Autors.
[2] Beide Stoffe gehören zu den Phenylpyrazolen. Fipronil ist sehr langlebig im Boden und wird von Pflanzen aufgenommen (systemische Verteilung). Stoffe mit dieser Kombination von Langlebigkeit im Boden, systemische Verteilung in der Pflanze plus der Giftigkeit wird für den Kollaps der “Insektenfauna” (präziser: Arthropodenfauna) verantwortlich gemacht.
[3] Da die Resistenzentwicklung ein evolutionärer Prozess ist – und damit purer Zufall – kann eine Resistenz jederzeit auftreten. Die Wahrscheinlichkeit steigt jedoch bei höherem Einsatz.
[4] Da einige Stoffe als Gruppen geführt werden (z.B. Sulfonamide) ist die absolute Zahl höher.
UBA (2014): Antibiotika und Antiparasitika im Grundwasser unter Standorten mit hoher Viehbesatzdichte. Umweltbundesamt. Texte 27/2014
Grote M, Schwake-Anduschus C, Michel R, Stevens H, Heyser W, Langenkämper G, Betsche & Freitag M (2007): Incorporation of veterinary antibiotics into crops from manured soil. Landbauforschung Völkenrode 1 / (57):25-32
BfR (2011): Rückstände pharmakologisch wirksamer Stoffe in Lebensmitteln pflanzlichen Ursprungs Stellungnahme Nr. 051/2011 des BfR vom 2. November 2011. Bundesinstitut für Risikobewertung (BfR).
Bouvier G, Blanchard O, Momas I & Seta N (2006): Pesticide exposure of non-occupationally exposed subjects compared to some occupational exposure: a French pilot study. Sci Total Environ 366(1):74-91.
Davis MK, Boone JS, Moran JE, Tyler JW & Chambers JE (2008): Assessing intermittent pesticide exposure from flea control collars containing the organophosphorus insecticide tetrachlorvinphos. J Expo Sci Environ Epidemiol.18(6):564-70. doi: 10.1038/sj.jes.7500647.